- Created by Nicolas Stifani, last modified by Sarah Martin-Zement on Mar 25, 2022
You are viewing an old version of this page. View the current version.
Compare with Current View Page History
« Previous Version 63 Next »
Microscope droit Nikon Eclipse E-600
Pavillon Roger Gaudry, Local N-620
- Applications
- Lumière transmise
- Contraste de phase
- Lumière polarisée
- Fluorescence
- Caméra couleur
Sources lumineuses
Lampe halogène pour la lumière transmise
Lampe au mercure 100 W (350~600 nm) pour la fluorescence
| Pic d'émission (nm) | Puissance (mW) |
|---|---|
| 334 | 7 |
| 365 | 45 |
| 405 | 34 |
| 436 | 43 |
| 546 | 37 |
| 579 | 26 |
Spectre d'émission de la lampe HBO (anglais pdf) (Source)
Comparaison entre les spectres d'émission de lampe au mercure HBO vs XCite (anglais) (Source)
Manuel Lampe OSRAM HBO 100W/2 (anglais pdf)
Objectifs
10x/0.3 Air Ph1 WD 16.0
40x/0.75 Air Ph2 WD 0.72
- 100x/1.3 Huile Ph3 WD 0.2
| Position | Nom | Marque | Nom complet | Identifiant | Grossissement | Ouverture numérique | Immersion | Type | Distance de travail (mm) | Transmittance (% [nm]) | Technique | Épaisseur du couvre-objet (mm) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 10x/0.3 Air | Nikon | 10x/0.3 Air Plan Fluor Ph1 DLL | 10x | 0.3 | Air | Plan Fluor | 16 | >75% [400-800] | BF, Pol, PhC, Fluo | 0.17 | |
| 2 | 40x/0.75 Air | Nikon | 40x/0.75 Air Plan Fluor Ph2 DLL | 40x | 0.75 | Air | Plan Fluor | 0.72 | >80% [400-750] Max % @500nm | BF, Pol, PhC, Fluo | 0.17 | |
| 3 | 100x/1.3 Huile | Nikon | 100x/1.3 Oil Plan Fluor Ph3 DLL | 100x | 1.3 | Huile | Plan Fluor | 0.2 | >75% [400-800] Max % @500nm | BF, Pol, PhC, Fluo | 0.17 | |
| 4 | Vide | |||||||||||
| 5 | Vide | |||||||||||
| 6 | Vide |
BF: Champ clair (Bright-field)
Pol: Lumière polarisée
PhC: Contraste de phase
- Cubes de filtres
- DAPI/Hoechst/AMCA
- FITC/EGFP
- TRITC/Rhodamine
- Texas Red
| Position | Nom | Marque | Identifiant | Filtre d'excitation | Miroir dichroïque | Filtre d'émission | Commentaire |
|---|---|---|---|---|---|---|---|
| 1 | DAPI/Hoechst/AMCA | Chroma | Cube set 31000v2 | 350/50x [325-375] | 400LP | 460/50m [435-485] | |
| 2 | FITC/EGFP | Chroma | Cube set 41001 | 480/40x | 535/50m [510-560] | ||
| 3 | TRITC/Rhodamine | Chroma | 545/30x [530-560] | 570LP | 620/60m [590-650] | ||
| 4 | Texas Red | Chroma | 560/55x | 595LP | 645/75m [607-682] | ||
| 5 | Vide | ||||||
| 6 | Vide |
- Détecteur
- Caméra couleur CMOS Nikon DS-Ri2 4908 x 3264 pixels, 14-bit, 6 images/s à pleine résolution
- Allumez l’ordinateur (#1)
- Allumez la multiprise d’alimentation du microscope (#2)
Si la fluorescence est nécessaire, allumez le module d’alimentation de la lampe au mercure (#3A) et appuyez sur le bouton ignition (#3B)
La lampe au mercure doit être allumée pendant au moins 30 minutes avant d’être éteinte et vice-versa
Si la lumière transmise est nécessaire, allumez l’interrupteur sur le côté droit du microscope (#4)
Utilisez vos identifiants UdM pour vous connecter à Windows
Démarrez le logiciel NIS-Elements
Lors de la première utilisation il est nécessaire d’importer les paramètres du microscope dans le logiciel. Pour ce faire, suivre les instructions Paramétrage du logiciel.
- Enregistrez vos données
- Fermez le logiciel NIS-Elements
- Transférez vos données sur le disque D: (Data Storage) ou sur votre disque dur externe et les supprimer du disque local C:
- Éteindre l'ordinateur
- Si utilisé, nettoyez l’objectif à huile avec du nettoyant et du papier à lentille
Si la fluorescence a été utilisée, éteindre le module d’alimentation de la lampe au mercure (#3A)
La lampe au mercure doit être allumée pendant au moins 30 minutes avant d’être éteinte et vice-versa
- Si la lumière transmise a été utilisée, éteindre la lampe halogène sur le coté droit du microscope (#4)
- Éteindre la multiprise d’alimentation du microscope (#2)
- Attendre que les lampes aient refroidies et couvrir l’instrument avec la housse de protection
Rappels Importants
- Récupérez vos échantillons notamment ceux dans le microscope
- Laissez le microscope et l’espace de travail propre
- Les fichiers peuvent être sauvés temporairement (pendant l’acquisition) sur le disque local C: (bureau)
- À la fin de chaque session, copiez vos données sur votre disque externe et supprimez-les du disque local C:
- Vous pouvez stocker vos fichiers sur le disque D: (Data Storage). Si vous utilisez ce disque, veuillez créer un dossier par laboratoire en utilisant le nom de famille du chercheur principal. À l’intérieur, créez un dossier par utilisateur (Prénom_Nom).
Dans tous les cas, ne stockez pas vos fichiers sur le disque C:
Lors de la première utilisation, il est nécessaire d’importer dans le logiciel les paramètres spécifiques au microscope. Cette procédure est habituellement réalisée lors de la séance de formation.
Il est cependant également possible de l’utiliser pour réinitialiser le logiciel si celui-ci ne s‘affiche pas correctement par exemple.
Attention, cette procédure supprimera tous vos protocoles d’expérience et rétablira les paramètres originaux du logiciel.
- Si ouvert, fermez le logiciel NIS-Elements et attendre sa fermeture complète (jusqu’à 30 secondes)
- Sur le Bureau ouvrez le dossier Softwares
- Ouvrez le logiciel NIS Settings Utility
- Cliquez sur l’onglet Import
- Cliquez sur Browse
- Naviguez jusqu’à votre bureau
- Sélectionnez le fichier Nikon-E600 Settings.bin
- Cliquez Open
- Sélectionnez tous les items
- Cliquez Import
- Cliquez OK
- Fermez le logiciel NIS Settings Utility
- Vous pouvez ensuite réouvrir le logiciel NIS-Elements
Les schémas suivants permettent de suivre le trajet lumineux en lumière transmise (fond clair, contraste de phase et lumière polarisée) et en lumière réfléchie (fluorescence).
Error rendering macro 'viewpdf'
com.atlassian.confluence.macro.MacroExecutionException: com.atlassian.confluence.macro.MacroExecutionException: The viewfile macro is unable to locate the attachment "LightPath_Nikon E600.pdf" on this page
Manuels disponibles version anglaise.
Section disponible dans la version anglaise.
Section disponible dans la version anglaise.
Dépannage
Ceci peut survenir lorsque le logiciel NIS-Elements ne parvient pas à établir la connexion avec la caméra par exemple lorsque la caméra n'est pas allumée.
- Fermez le logiciel NIS-Elements
- Allumez la caméra (la multiprise du microscope et l'interrupteur sur le dessus de la caméra)
- Vérifiez la connexion USB entre la caméra et l'ordinateur
- Allumez le logiciel NIS-Elements
FAQ
Non. C'est un microscope droit conçu pour l'observation de spécimen montés entre lame et lamelles (d'épaisseur 0.17mm).
Plus de dépannage et de FAQs sont disponibles dans la version anglaise.
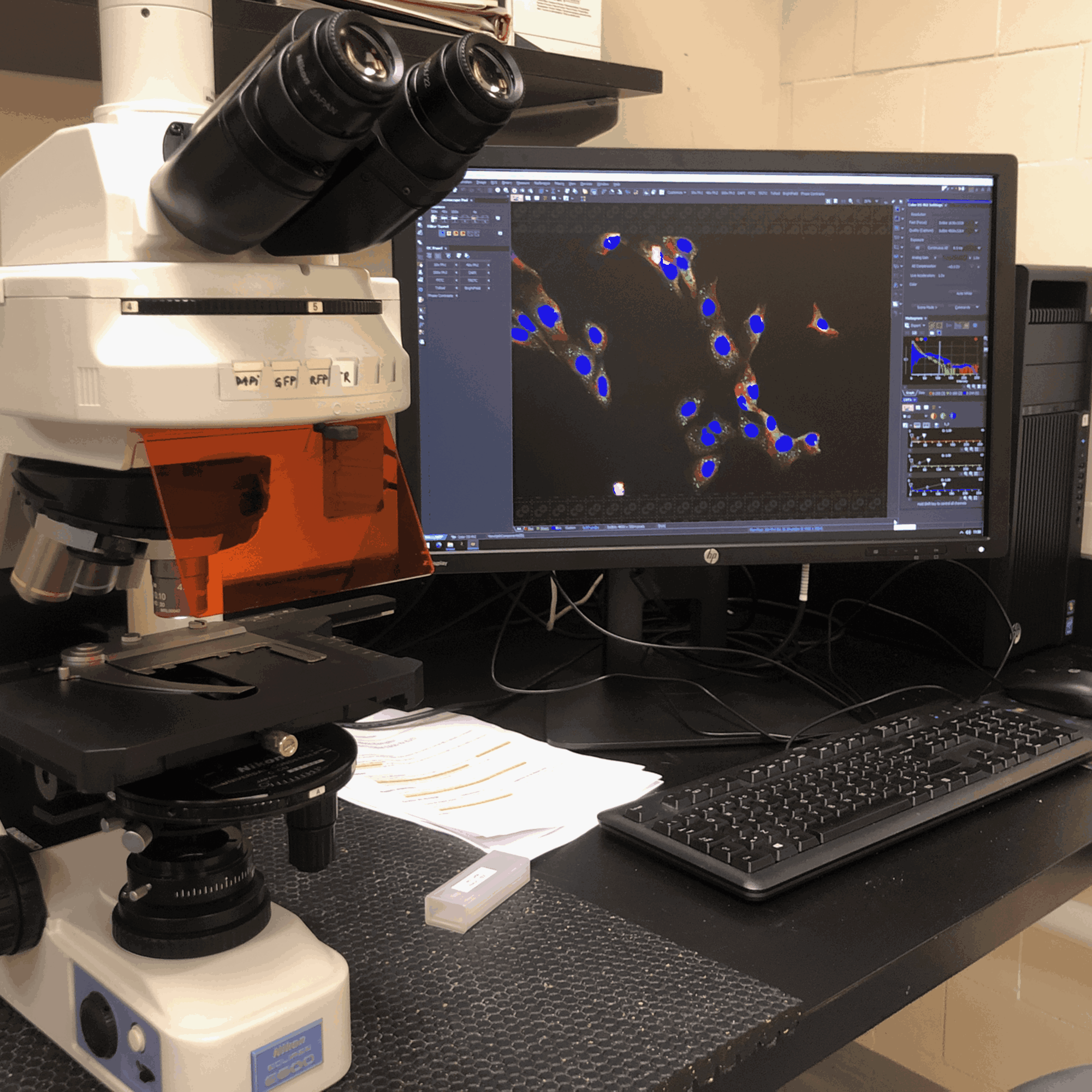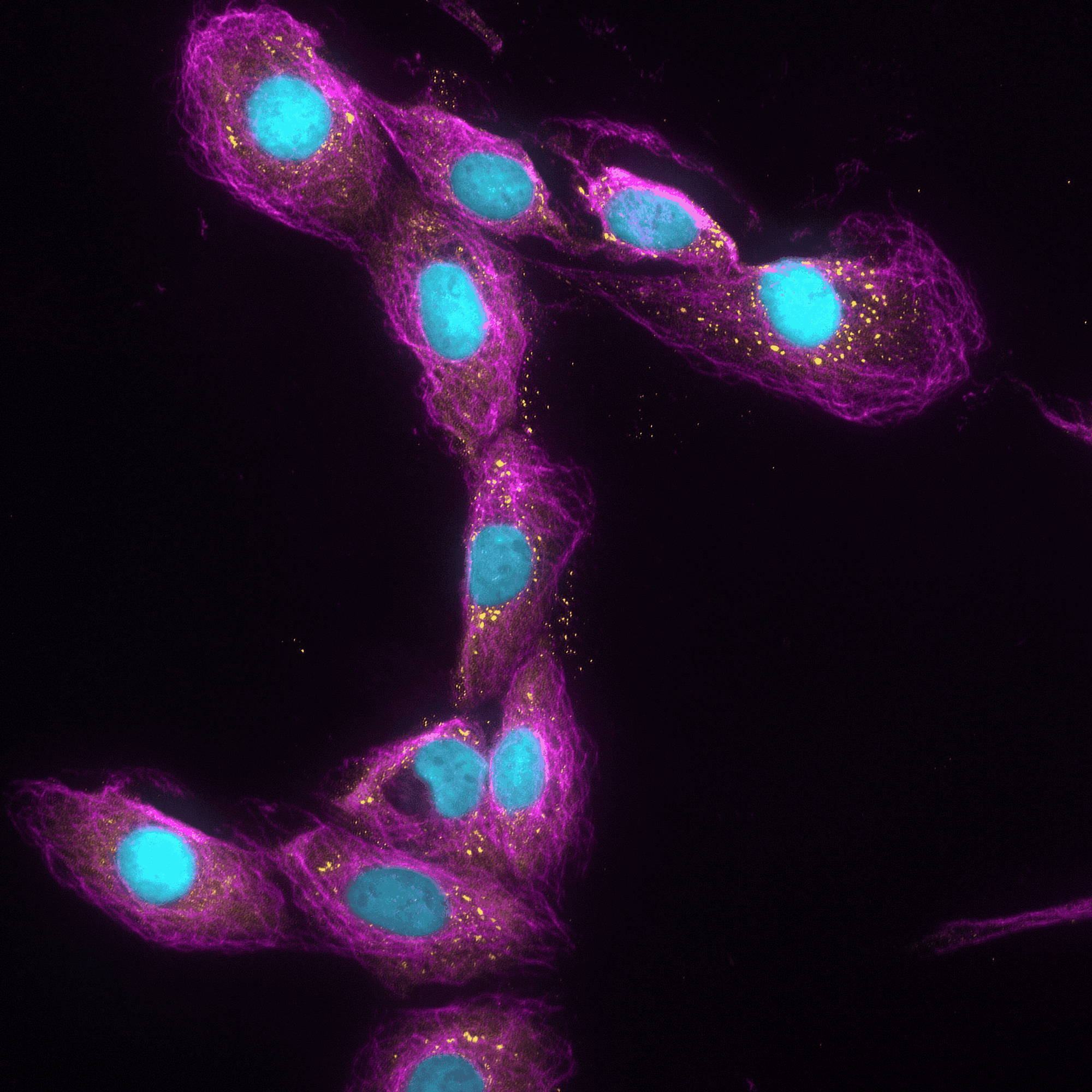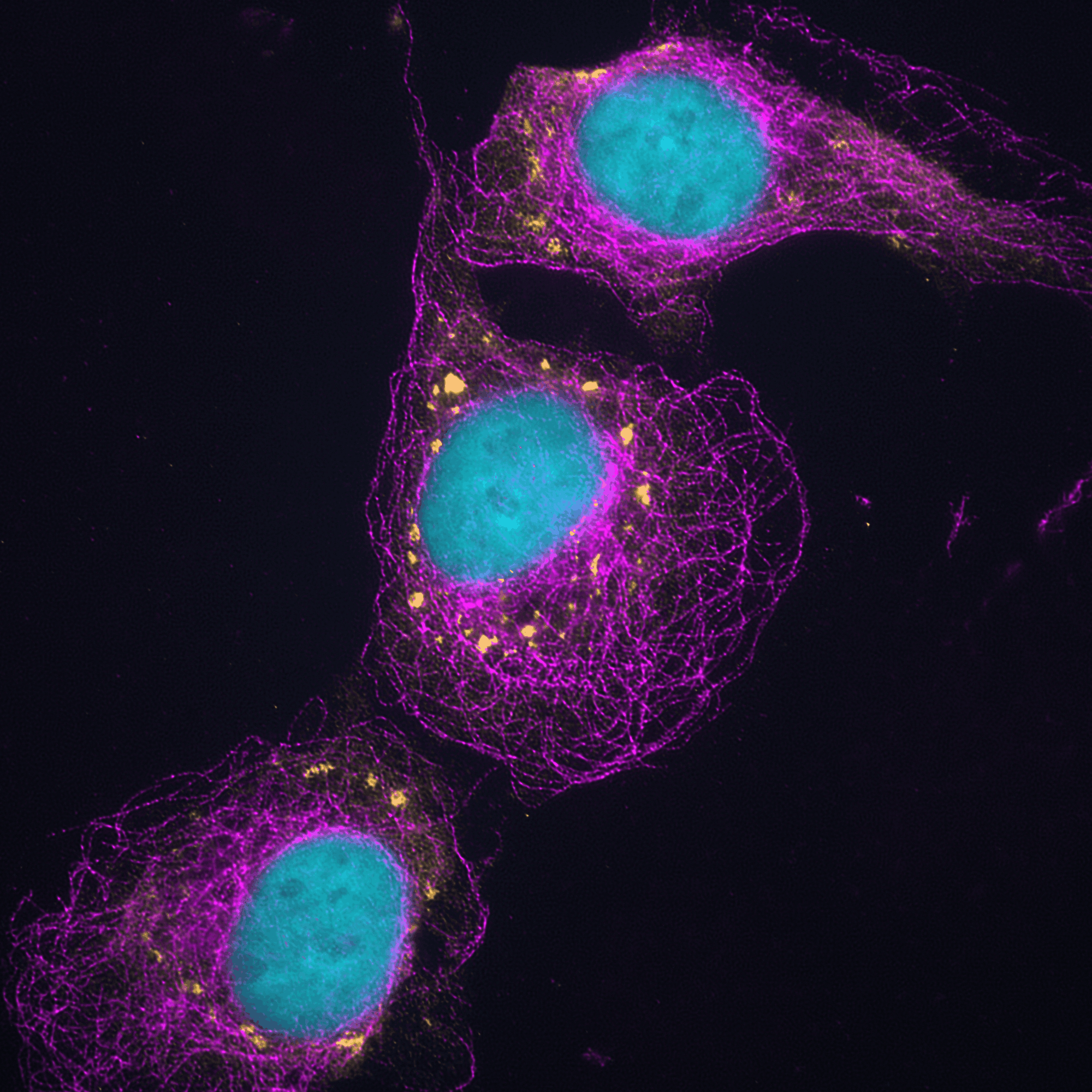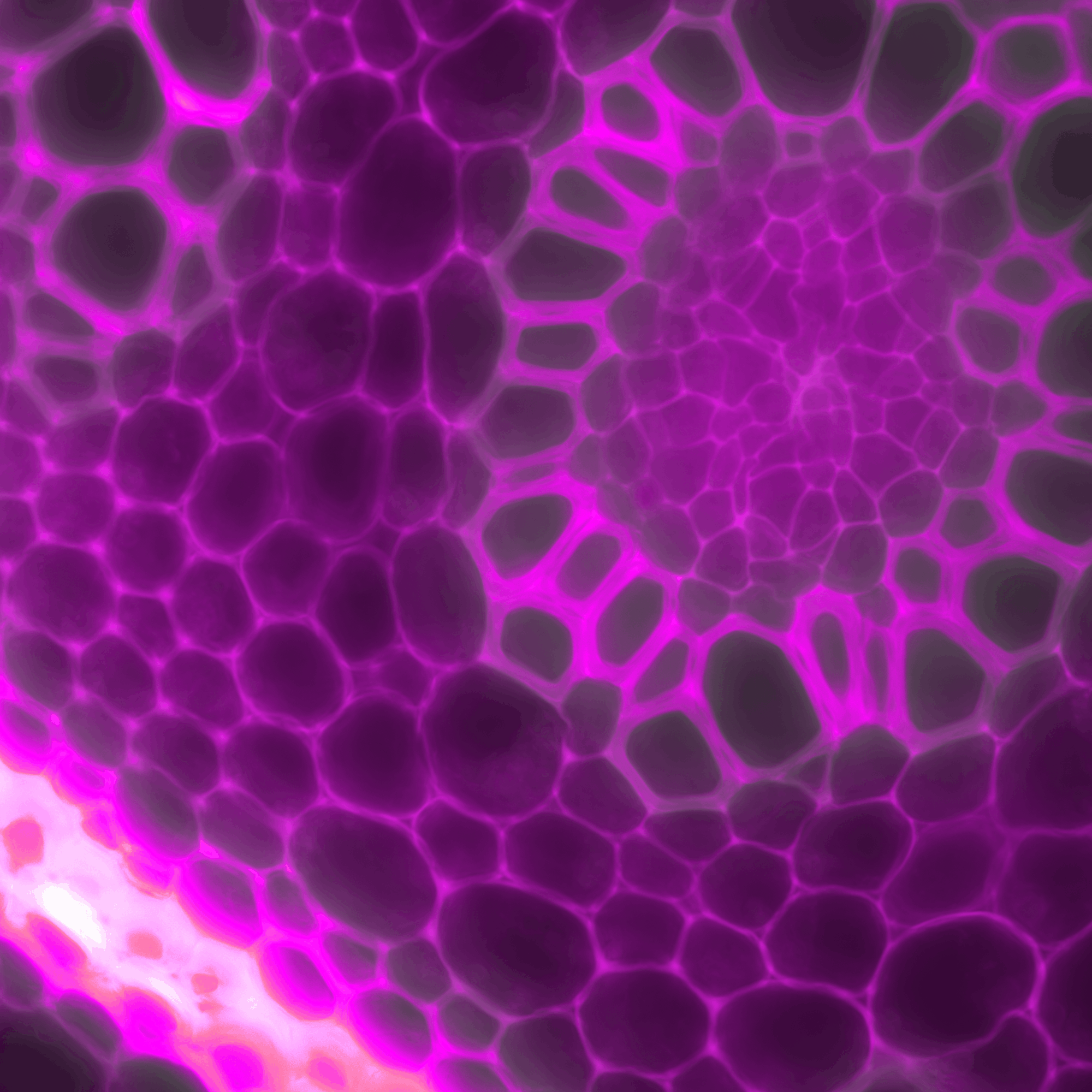
Cellules courtoisie de Benoit Bessette et Monique Vasseur (Biochimie)
Images courtoisie de Dre Shirley Campbell et Emilie Fiola-Masson (Pharmacologie)
- No labels