| Tabs Page |
|---|
| id | Description |
|---|
| title | Description |
|---|
| Microscope droit Olympus BX63Pavillon P-G Desmarais, Local 5308-2
Tarif d'utilisation Microscope Avancé tier 1 Instrument octroyé au Dre Marina Martinez par la Fondation Canadienne pour l'Innovation (FCI). - Applications
- Lumière transmise
- Lumière polarisée. DIC
- Fluorescence
- Caméra couleur
Sources lumineuses
Objectifs 4x/0.16 Air WD 16 10x/0.4 Air WD 3.1 - 20x/0.75 Air WD 0.6
40x/0.95 Air WD 0.18 60x/1.35 Huile WD 0.15 - 100x/1.4 Huile WD 0.13
- Vide
| Expand |
|---|
| title | Objectives complete specifications |
|---|
|
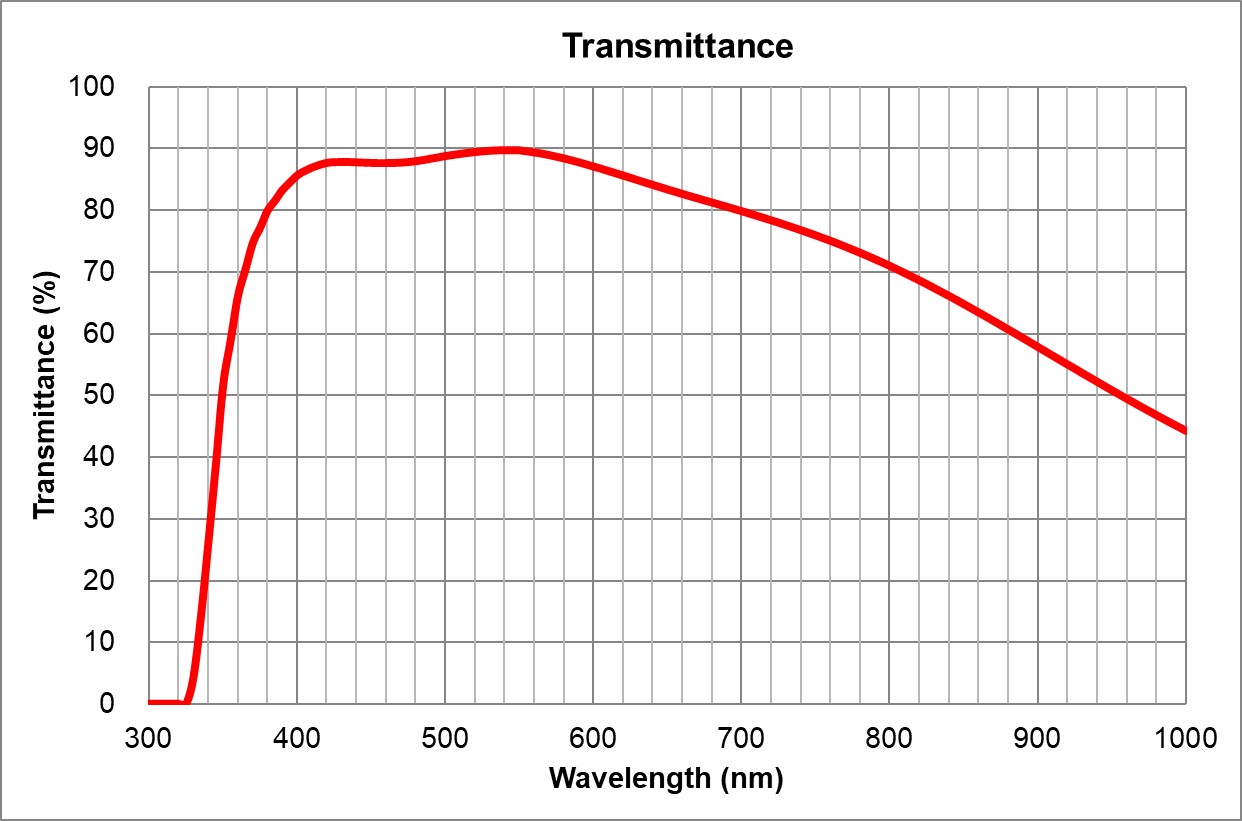
| Position | Nom | Marque | Nom complet | Identifiant | Ouverture numérique | Immersion | Distance de travail (mm) | Transmittance
(% [nm]) | Technique | Épaisseur du couvre-objet (mm) |
|---|
| 1 | 4x/0.16 Air | Olympus | 4x/0.16 Air UPlanSApo | | 0.16 | Air | 16 | >90% at 550nm
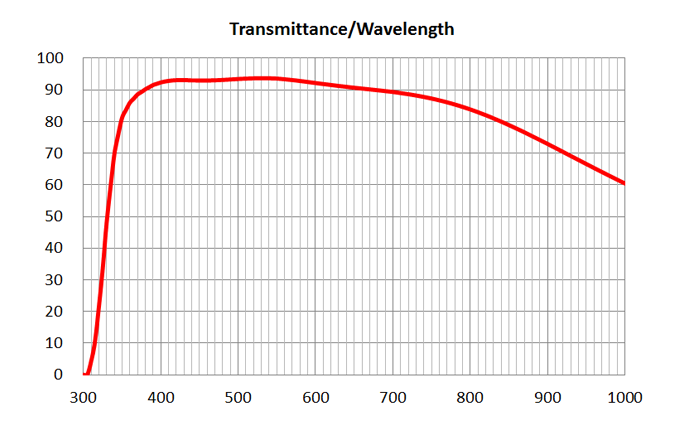 | BF, Fluo | - | | 2 | 10x/0.4 Air | Olympus | 10x/0.4 Air
UPlanSApo | UPLXAPO10X.pdf | 0.4 | Air | 3.1 | ~90% at 550nm
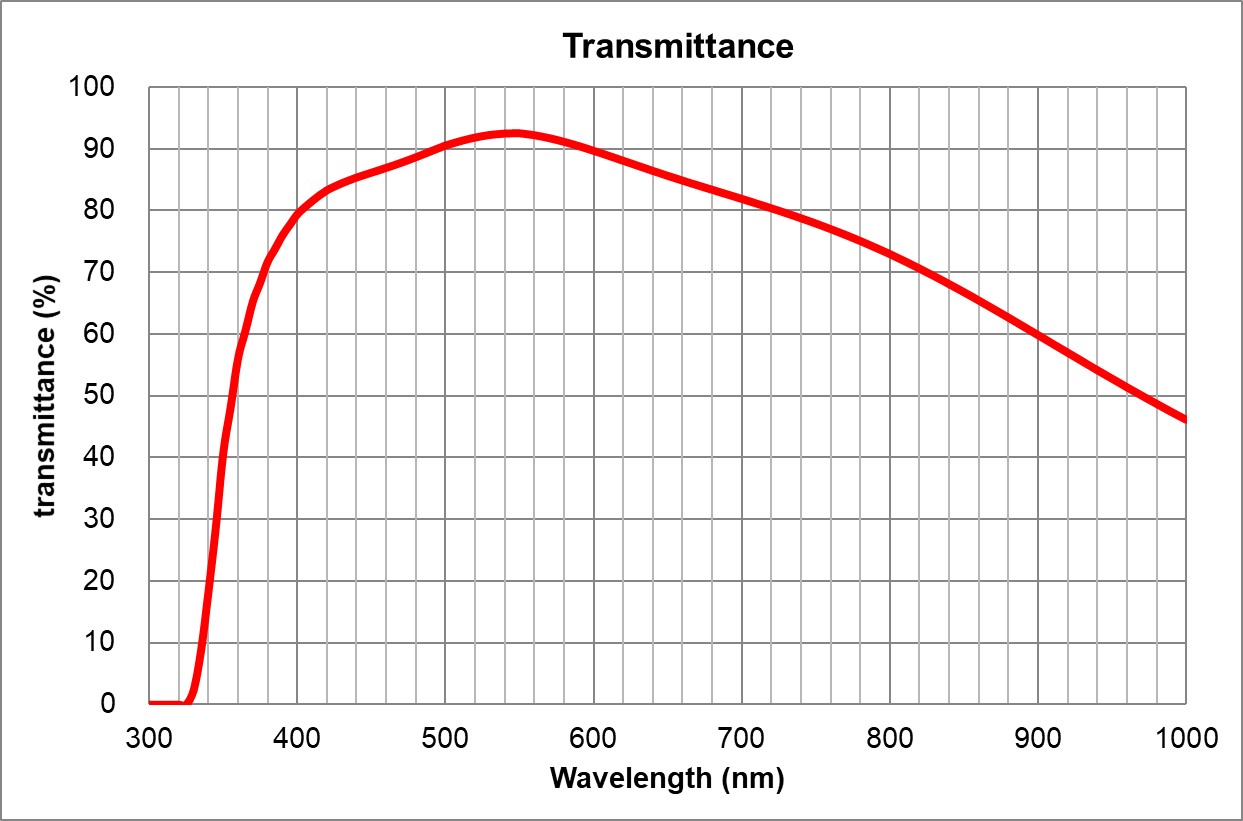
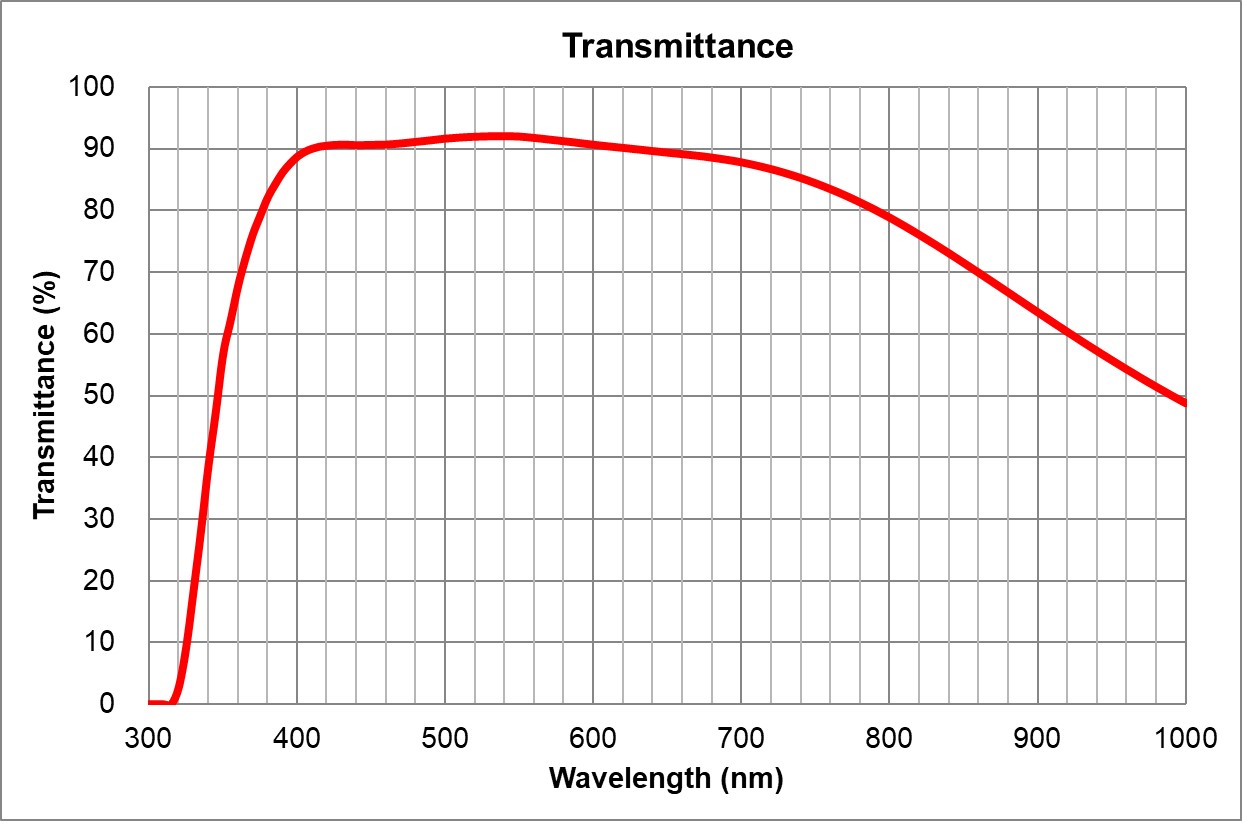 | BF, Pol, DIC, Fluo | 0.17 | | 3 | | Olympus | 20x/0.75 Air
UPlanSApo | | 0.75 | | 0.6 | >90% at 550nm
 | BF, Pol, DIC, Fluo | 0.17 | | 4 | 40x/0.95 Air | Olympus | 40x/0.95 Air
UPlanSApo | | 0.95 | Air | 0.18 | ~90% at 550nm
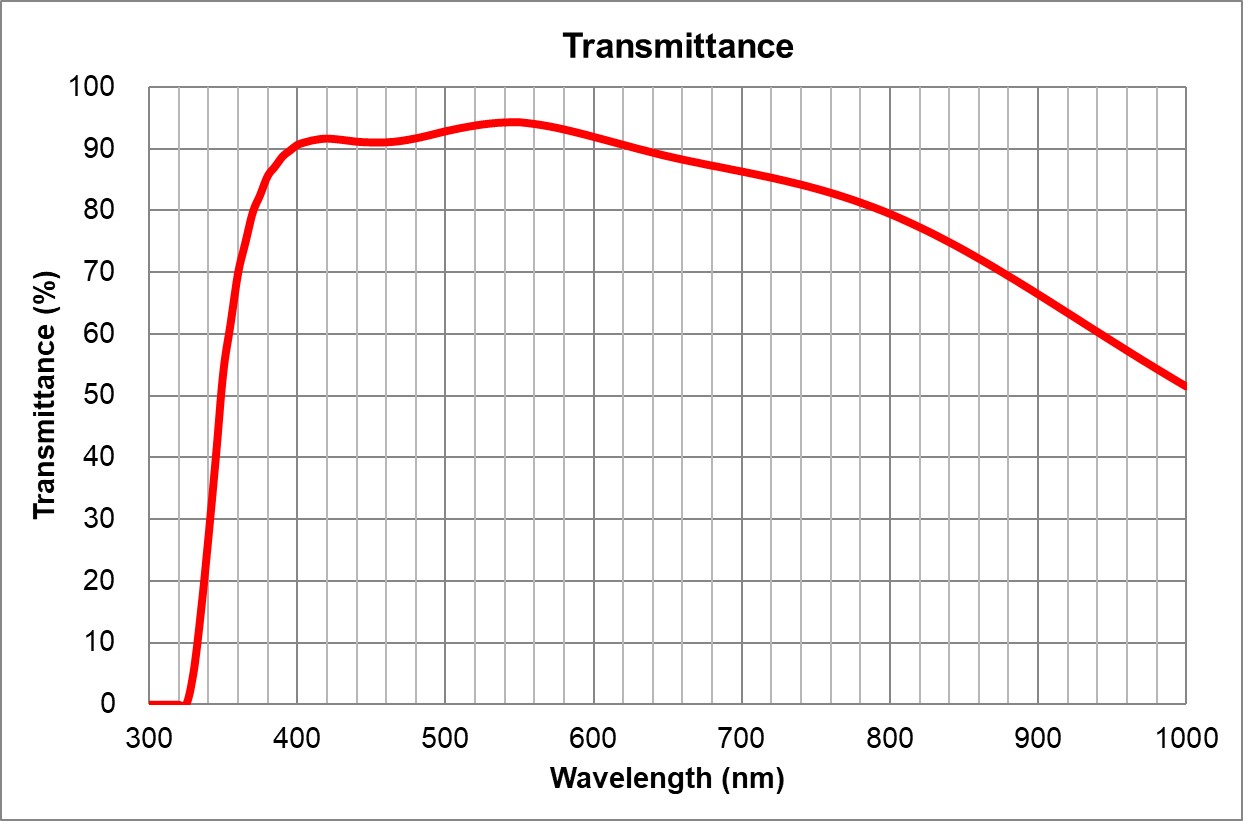
 | BF, Pol, DIC, Fluo | Adjustable 0.11-0.23 | | 5 | 60x/1.35 Huile | Olympus | 60x/1.35 Huile
UPlanSApo | | 1.35 | | 0.15 | ~90% at 550nm
 | BF, Pol, DIC, Fluo | 0.17 | | 6 | | Olympus | 100x/1.4 Huile
UPlanSApo | | 1.4 | | 0.13 | ~90% at 550nm
 | BF, Pol, DIC, Fluo | 0.17 | | 7 | |
|
|
|
| |
|
|
|
|
BF: Bright-field
Pol: Polarized light
DIC: Differential interference contrast
Fluo: Fluorescence |
- Cubes de filtres
- Vide
- DAPI
- FITC
- TRITC
- mCherry
- DAPI/FITC/TRITC/Cy5/Cy7
- Vide
- u-FDI CT
| Expand |
|---|
| title | Filters complete specifications |
|---|
|
| Position | Name | Brand | ID | Excitation Filter | Dichroic mirror | Emission Filter | Comments |
|---|
| 1 | Empty |
|
|
|
|
|
| | 2 | DAPI | Olympus | U-FUNA | 360-370 | 410LP | 420-460 | | | 3 | FITC | Olympus | U-FBNA | 470-495 | 505LP | 510-550 | | | 4 | TRITC | Olympus | U-FGWA | 530-550 | 570LP | 575-625 | | | 5 | mCherry | Olympus | U-FYW | 540-585 | 595LP | 600LP | | | 6 | DAPI/FITC/TRITC/Cy5/Cy7 |
| LED DA/ FI/TR/CY5/C Y7-5X-A-000 | 5 filters within the Novem FF01-387/11 FF02-485/20 FF01-560/25 FF01-650/13 FF01-740/13
| FF408/504/581/667/762-Di01 | FF01-440/521/607/694/809 |
| | 7 | Empty |
|
|
|
|
|
| | 8 | DIC Analyzer | Olympus | U-FDICT DIC | - | - | - | DIC Analyzer |
|
- Détecteur
- Olympus DP80 double détecteur (couleur et monochrome) camera CCD, 6.45 x 6.45 um pixel size,15 images/s à résolution maximale, 55% QE at 550nm
Mode couleur 4080 x 3072 pixels, 24-bit
Mode Monochrome 1360 x 1024 pixels, 14-bit
Olympus_DP80 Camera_User Guide-1.pdf
|
| Tabs Page |
|---|
| id | Guide d'utilisation |
|---|
| title | Guide d'utilisation |
|---|
|
| UI Expand |
|---|
| expanded | true |
|---|
| title | Démarrage |
|---|
| - Retirez la housse de protection du microscope
- Allumez l’ordinateur (#1)
- Allumez la multiprise d’alimentation du microscope (#2)
Allumez l'ecran tactile du microscope (l’interrupteur est à sur le côté droit du microscope (#3) Utilisez vos identifiants UdM pour vous connecter à Windows
| Info |
|---|
Lors de la première utilisation il est nécessaire d’importer les paramètres du microscope dans le logiciel. Pour ce faire, suivre les instructions Première Utilisation. |
Démarrez le logiciel CellSens Dimension
|
| UI Expand |
|---|
| title | Première Utilisation |
|---|
| Lors de la première utilisation, il est nécessaire d’importer dans le logiciel les paramètres spécifiques au microscope. Cette procédure est habituellement réalisée lors de la séance de formation.
Il est cependant également possible de l’utiliser pour réinitialiser le logiciel si celui-ci ne s‘affiche pas correctement par exemple. | Note |
|---|
Attention, cette procédure supprimera tous vos protocoles d’expérience et rétablira les paramètres originaux du logiciel. |
- Si ouvert, fermez le logiciel CellSens Dimension et attendre sa fermeture complète (jusqu’à 30 secondes)
- Sur le Bureau ouvrez le dossier Documentation
- Double-cliquez sur Settings for BX-63
- Un script s'excutera et une fenêtre noire apparaitra brièvement
- Vous pouvez ensuite réouvrir le logiciel CellSens Dimension
|
| UI Expand |
|---|
| title | Procédure pour le chargement des échantillons |
|---|
| Cette procédure permet de mettre le microscope dans une configuration sécuritaire et d'effectuer une calibration de la mise au point. À la fin de cette procédure le microscope sera prêt pour l'acquisition.
| UI Expand |
|---|
| title | Première mise au point |
|---|
| Sur l’écran tactile du microscope : - Appuyez sur Full Operation
Appuyez sur 4x pour sélectionner l'objectif 4x
| Info |
|---|
L’objectif 4x est le plus sécuritaire car il possède la plus grande distance de travail (16 mm). L'échantillon apparaitra parfaitement net bien avant que l'objectif ne s'approche de celui-ci. Il est recommandé de toujours faire la première mise au point avec l'objectif le plus sécuritaire. Les objectifs sont para-focaux, faire la mise au point avec l'objectif le plus sécuritaire vous permettra ensuite de trouver facilement votre échantillon avec un autre objectif. |
- Appuyez sur Escape pour faire monter les objectifs dans leur position la plus haute
Placez la lame de test sur la platine du microscope avec le couvre-objet vers l'objectif
| Note |
|---|
| Toujours utiliser la lame de test pour effectuer la première mise au point. |
- Si nécessaire, déplacez la platine pour que l'échantillon soit centré sur l'objectif
Sur l’ordinateur : Ouvrez le logiciel CellSens Dimension - Attendre l'ouverture du logiciel (oui c'est long...)
En bas à droite de la fenêtre, sélectionnez BF ou la fluorescence désirée (DAPI, FITC, TRITC ou mCherry) pour activer la configuration Ajustez la mise au point avec la molette principale tout en regardant dans les oculaires jusqu'à ce que l'image soit parfaitement nette | Note |
|---|
La mise au point est aux alentours de Z = 19000 um. La valeur de la position en Z est visible sur l'écran tactile. |
- En bas à droite de la fenêtre, sélectionnez Off pour éteindre l'illumination
|
| UI Expand |
|---|
| title | Mise au point secondaire |
|---|
|
| Warning |
|---|
| Faire d’abord la première mise au point avec l'objectif le plus sécuritaire avant de sélectionner un autre objectif et de poursuivre avec la mise au point secondaire. |
| UI Expand |
|---|
| title | Mise au point avec les objectifs à air |
|---|
| Après avoir effectué la première mise au point, sur l’écran tactile du microscope : Appuyez sur 10x, 20x ou 40x pour sélectionner l'objectif désiré | Info |
|---|
L’objectif 40x est le meilleur objectif à Air car il possède le plus grand nombre de corrections optiques (Plan Apochromat) et la plus grande ouverture numérique (0.95). Il offre une résolution latérale de 420nm à une longueur d'onde de 550nm. |
- En bas à droite de la fenêtre, sélectionnez BF ou la fluorescence désirée (DAPI, FITC, TRITC ou mCherry) pour activer la configuration
Ajustez la mise au point avec la molette de précision tout en regardant dans les oculaires jusqu'à ce que l'image soit parfaitement nette - Sélectionnez Off pour éteindre l'illumination
- Votre échantillon est prêt pour l’acquisition !
|
| UI Expand |
|---|
| title | Mise au point avec les objectifs à l'huile |
|---|
| Après avoir effectué la première mise au point, sur l’écran tactile du microscope : Appuyez sur 60x Oil (1.35), 100x Oil (1.4) pour sélectionner l'objectif désiré. Le microscope relèvera automatiquement les objectifs pour que l'échantillon soit accessible. | Info |
|---|
L'objectif 100x est le meilleur objectif à l'huile car il possède le plus grand nombre de corrections optiques (Plan Apochromat) et la plus grande ouverture numérique (1.4). Il offre une résolution latérale de 240nm à une longueur d'onde de 550nm. |
- Déposer une goutte d’huile sur votre échantillon
Dans le logiciel CellSens Dimension : - Cliquez sur OK
- En bas à droite de la fenêtre, sélectionnez BF ou la fluorescence désirée (DAPI, FITC, TRITC ou mCherry) pour activer la configuration
- Ajustez la mise au point avec la molette de précision tout en regardant dans les oculaires jusqu'à ce que l'image soit parfaitement nette
- Sélectionnez Off pour éteindre l'illumination
- Votre échantillon est prêt pour l’acquisition !
|
|
|
| UI Expand |
|---|
| - Les fichiers peuvent être sauvés temporairement (pendant l’acquisition) sur le disque local C: (bureau)
- À la fin de chaque session, copiez vos données sur votre disque externe et supprimez-les du disque local C:
- Vous pouvez stocker vos fichiers sur le disque D: (Data Storage). Si vous utilisez ce disque, veuillez créer un dossier par laboratoire en utilisant le nom de famille du chercheur principal. À l’intérieur, créez un dossier par utilisateur (Prénom_Nom).
| Note |
|---|
Dans tous les cas, ne stockez pas vos fichiers sur le disque C: |
|
| UI Expand |
|---|
| - Enregistrez vos données
- Fermez le logiciel CellSens Dimension
- Transférez vos données sur le disque D: (Data Storage) ou sur votre disque dur externe et les supprimer du disque local C:
- Éteindre l'ordinateur
- Si utilisé, nettoyez les objectifs à huile avec du nettoyant et du papier à lentille
- Éteindre la multiprise d’alimentation du microscope (#2)
- Couvrir l’instrument avec la housse de protection
| Note |
|---|
| - Récupérez vos échantillons notamment ceux dans le microscope
- Laissez le microscope et l’espace de travail propre
|
|
|
| Tabs Page |
|---|
| id | Trajet lumineux |
|---|
| title | Trajet lumineux |
|---|
|
Les schémas suivants permettent de suivre le trajet lumineux en lumière transmise (fond clair, contraste de phase et lumière polarisée) et en lumière réfléchie (fluorescence).
| View file |
|---|
| name | Olympus_BX63_Lightpath.pdf |
|---|
| height | 250 |
|---|
|
|
| Tabs Page |
|---|
|
Manuels disponibles version anglaise.
|
| Tabs Page |
|---|
| id | Fiche Technique |
|---|
| title | Fiche Technique |
|---|
|
Section disponible dans la version anglaise.
|
| Tabs Page |
|---|
| id | Dépannage et FAQ |
|---|
| title | Dépannage et FAQ |
|---|
| Dépannage| UI Expand |
|---|
| title | Le microscope ne s'allume pas, que dois-je faire? |
|---|
| Veuillez vous assurer que l’écran tactile du microscope est allumé. L'interrupteur n'est pas facilement accessible et se situe à l'arrière à droite de l'écran tactile. |
FAQ| UI Expand |
|---|
| title | Puis-je utiliser ce microscope pour observer des cellules en culture? |
|---|
| Non. C'est un microscope droit conçu pour l'observation de spécimen montés entre lame et lamelles (d'épaisseur 0.17mm). |
Plus de dépannage et de FAQs sont disponibles dans la version anglaise. |
|